华南植物园分子生物分析及遗传改良研究中心何玉梅博士后等科研人员通过裂殖酵母的研究阐明了一条在真核生物中高度保守的二硫化物胁迫调控途径—Oxs1-Pap1途径(He et al. 2017. Nucleic Acids Res. 45: 106–114)。陈岩博士等科研人员在区永祥研究员的指导下,在后续的机制研究中发现,在裂殖酵母中,Oxs1核输出信号肽可以作为竞争性底物,减少Crm1介导的Pap1蛋白的核输出,使Pap1在核中滞留。在这种机制下,当Oxs1核输出信号肽被过表达时,细胞核中便能积累较高浓度的Pap1,进而上调受Pap1调控的与胁迫耐受相关的基因以保护裂殖酵母对抗二硫化物胁迫。
有趣的是,以往的研究发现Crm1介导核蛋白输出若在人体中过度出现,会削弱肿瘤抑制子的作用使不正常的细胞不断产生,另外这个途径也会被多种人类病毒利用使其生存和繁殖,使人产生多种疾病。所以,通过过表达Oxs1核输出信号而阻断Crm1介导核蛋白输出的方法,很可能能作为目前正在测试的阻断肿瘤抑制因子p53核输出的化学药物的替代物,以用于癌症治疗;或用于阻断那些HIV-1和流感病毒成熟所必需的蛋白质,从而用于HIV和病毒性流感的治疗。
相关研究成果已近期发表在国际学术期刊Genetics(2018影响因子4.075)上。该研究得到国家重点研发计划项目,国家自然科学基金以及广东省应用型科技研发专项资金项目的资助。论文链接:http://www.genetics.org/content/210/3/857
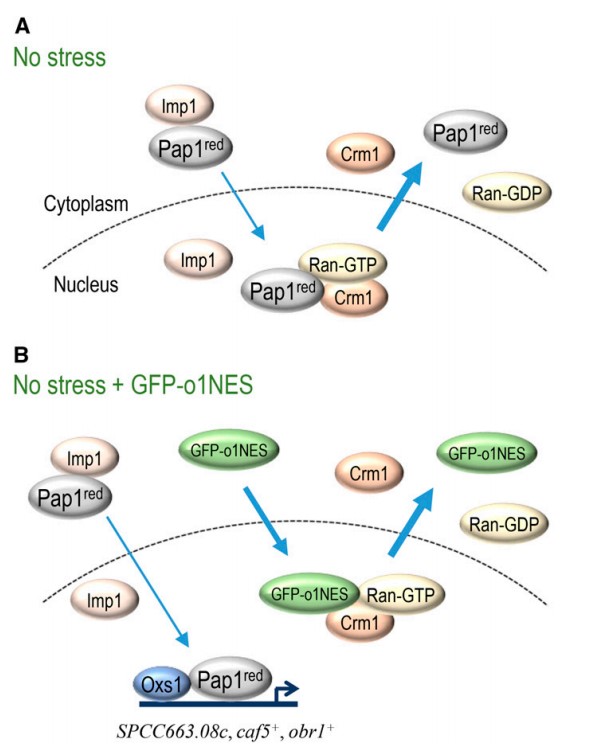
图 1 Crm1 竞争底物影响Pap1 的核质穿梭。(A) 在没有胁迫条件下, Crm1-介导的 Pap1red (Pap1的还原型) 核输出多于进核的Pap1red。 (B) 当GFP-oxs1 NES过表达的时候,这个因子会与Crm1-介导的核输出竞争,使Pap1red 更多地滞留于细胞核并激活抗药性基因的表达。
