猕猴桃为我国特有的雌雄异株多年生果树,因其丰富的营养价值和独特的风味而成为全球性重要的新兴水果。随着我国及世界猕猴桃产业的发展,如何快速高效的创制优异特色新种质并培育新品种成为制约产业发展的关键。目前,基于成簇规律间隔短回文重复序列/成簇规律间隔短回文重复序列关联蛋白(clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins, CRISPR/Cas)系统发展起来的CRISPR/Cas9基因组编辑技术已成为作物遗传改良和基因功能研究的重要工具,但该系统的工作效率在不同的物种中存在较大的差异。在猕猴桃中,目前还没有成熟可用的基因组编辑系统。
中科院华南植物园博士研究生汪祖鹏在黄宏文研究员和刘义飞副研究员的指导下,基于前期研究基础,建立了一种新的快速高效的成对sgRNA的Cas9双元表达载体的构建策略,以此产生了包含四个靶向猕猴桃八氢番茄红素脱氢酶基因(AcPDS)的sgRNA的成对sgRNA/Cas9载体。与先前的成对sgRNA克隆方法相比,该策略仅需要合成两种含sgRNA的引物,从而大幅降低了成本。该研究进一步比较了两种不同的sgRNA表达盒类型(多顺反子tRNA-sgRNA体系(PTG)和传统CRISPR表达盒)在猕猴桃中的基因编辑效率。结果表明,在猕猴桃中PTG/Cas9系统的靶标突变效率相比传统的CRISPR/Cas9系统高出近10倍。最后,研究人员还发现两种系统均能成功地诱导由G418抗性愈伤组织再生的猕猴桃幼苗白化表型。该研究首次在猕猴桃中建立了多重高效的PTG/Cas9基因组编辑系统,相关研究结果为在其他植物或作物中进行基因组编辑效率的优化提供了借鉴和指导。
相关研究得到了国家自然科学基金(31471847和31572092)和中科院STS网络计划项目的支持(KFJ-EW-STS-076)。研究成果已在线发表在国际植物生物技术领域知名期刊Plant Biotechnology Journal上。
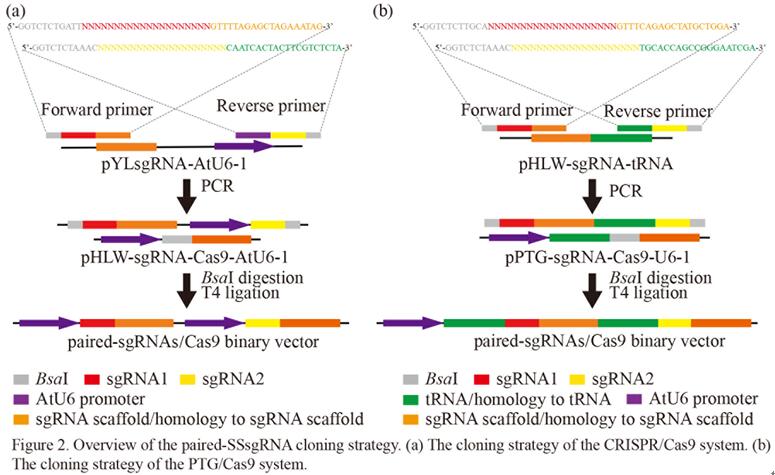
图1 成对sgRNA/Cas9双元表达载体快速构建策略
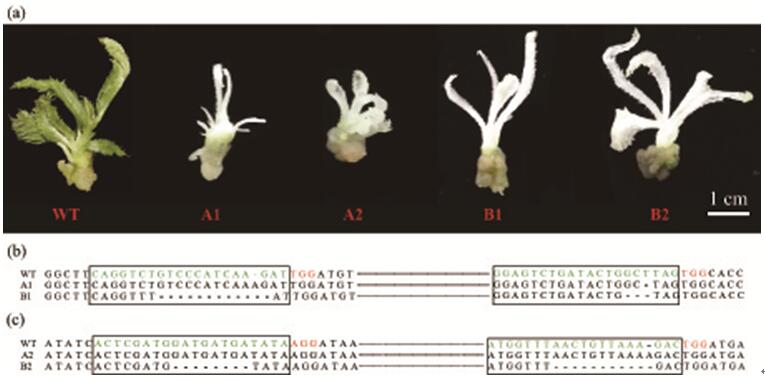
图2 由CRISPR/Cas系统的基因因编辑引起的猕猴桃白化表型

